安全性評価試験
安全性評価試験の重要性
どんな食品も絶対に安全とはいえないことを
ご存じですか?
食品が「安全である」とは、食品の国際規格「コーデックス」の「食品衛生に関する一般原則 (General Principles of Food Hygiene CXC 1-1969)」1)に基づくと、
『予期された方法や意図された方法で作ったり、食べたりした場合に、
その食品が食べた人に害を与えないという保証』があって初めて言えます。
そこで! 貴社にぴったりのプランが必ず見つかる
選べる安全評価
3プラン
始めます!
3つの安全性評価プラン
大規模な開発に向けスタートから
多くのエビデンスを取得する
1.大規模評価プラン
安全性を評価するための、
コンセンサスのある方法に基づいた
プランです。
安全性の検証を主たる目的とした
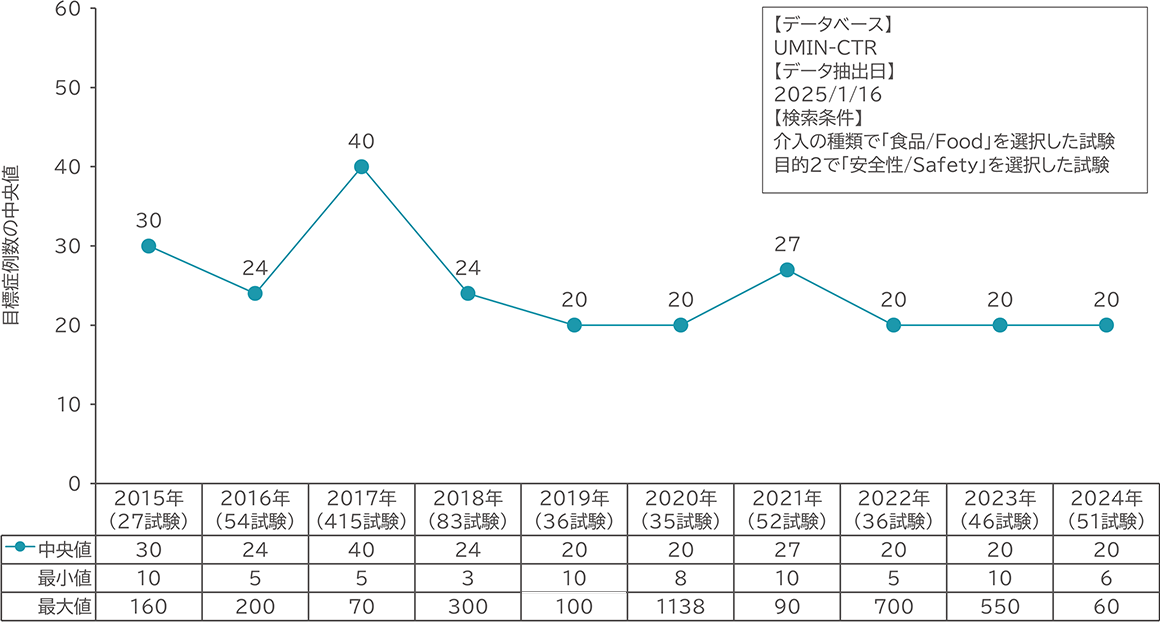
ヒト臨床試験の実施状況と目標症例数
我々は、UMIN-CTRに登録された臨床試験の中から介入として「食品」を選択しており、「安全性」を検証している試験を調査しました。2023年は、46件の安全性試験が実施され、目標症例数の中央値は20例でした。20例の安全性試験は、どの程度安全性を検証できるか考えたことはあるでしょうか?
14%の発現頻度の有害事象を95%以上の確率で少なくとも1件以上検出するために必要な症例数は、約20例と計算できます2)。特定保健用食品や機能性表示食品のガイドラインは、安全性の重要性は示すものの、具体的な試験デザインなどはありません。そのため、ICH-E1のような医薬品の開発に採用されているガイドライン2)を参考とすることが最善です。
そこで、我々は食品の安全性情報を収集するための臨床試験の実施体制を整備した、
「大規模安全性評価プラン」を
開発しました。
| 6カ月コース※1 | 12カ月コース※2 | |
|---|---|---|
| デザイン | 前後比較 | 前後比較 |
| ランダム化 | 無 | 無 |
| 盲検 | 非盲検 (オープン) | 非盲検 (オープン) |
| 対象者 | 健常人から疾病の境界域者に至るまでの範囲において、目的とする保健用途の対象として適切な者 | 健常人から疾病の境界域者に至るまでの範囲において、目的とする保健用途の対象として適切な者 |
| 介入 |
被験品 (1日摂取目安量) |
被験品 (1日摂取目安量) |
| 介入期間 | 24週間 | 48週間 |
| 来院回数
(測定回数) |
摂取前を含め12週間ごと | 摂取前を含め12週間ごと |
| 実施症例数 | 600例 | 110例 |
| 測定項目 |
|
|
- ※1
0.5%の頻度の遅発性の有害事象が観察できるとともに、より高頻度に発現した有害事象がその後の期間中に増加するのか、あるいは減少するのかを観察できる十分な症例数を設定したヒト臨床試験です。 - ※2
有害事象の中には介入期間が長くなるにつれて発現頻度または重症度が増すものがあり、介入開始後6カ月以上経って初めて発現する重篤な有害事象もあります。そのため、食品を12カ月間介入して得られた試験成績も重要です。有害事象と介入期間の関係についての十分な情報がないため、1年間の経過観察を必要とする症例数は、一定の発現率の有害事象を発見する確率と試験実施の実現性に基づいて判断されます。100例の試験参加者に対して最低1年間介入して得られた試験成績は、十分な安全性情報を有していると考えられます。1年間の介入期間中に何らかの重篤な有害事象が認められない場合には、そのような有害事象の1年間の累積発現率は3%未満と判断できます。
介入方法 (食品、素材など) の基礎研究データや先行研究データなど、安全性を評価する、または素材に関わるすべてのデータを提供いただき、それらデータを専門家が審査します。
当該プランを委託するには、専門家の審査通過が必要であり、ご依頼をいただいても情報不足や情報の品質によってはお断りさせていただく場合がございます。
スタートの費用は抑えつつ
毎年着実にエビデンスを積み重ねていく
2.積み上げ評価プラン
想定される消費者層のすべてに対して安全性を検証することを目的に試験を計画した場合、
試験の対象人数は膨大になり、同時に試験の費用も大きくなります。
そこで、オルトメディコでは、食品の安全性を考える企業様を応援するプランを開発しました。
想定する消費者層を対象に、毎年少しずつ安全性のエビデンスを取得しませんか?

提携検査機関へ消費者と販売会社をつなげ
情報収集の支援をおこなう
3.市販後製品評価プラン
現在、保健機能食品やいわゆる健康食品を販売する企業において、その製品の使用による健康被害を収集する経路として、①消費者自身による問い合わせ窓口 (お客様相談室) への報告の収集、または、②消費者が体調不良を理由に医療機関で診察を受け、診察した医師が「医師からの事故情報受付窓口 (愛称:ドクターメール箱)」より生命または身体に生じた被害に関する事故を報告する、もしくは、消費者が保健所に健康被害内容を届出する経路等が存在します。
しかし、販売企業が販売後情報を収集するにあたり、①については消費者自身の感覚や判断によるものであることから、摂取した食品の健康被害であるか定かでなく、情報の信ぴょう性が低いことが課題です。一方の医師による報告に関しては、消費者のすべてが医療機関を受診するわけではないことに加え、医師自身も「報告するほどではない」「健康食品が原因と断定できなかった」といった理由から報告されない場合もあり、いずれにしても、重大な事故に気が付いた時には手遅れになる場合もあります。
そこで、オルトメディコでは、販売製品の客観的安全性情報の収集を支援するプランを開発しました。

実際には、製品形状や機能性関与成分ごとに、ヒト臨床試験のデザインを設定する必要があります。
そこでは、各分野の専門医や研究者のほかに、統計学者なども加わり、多角的な視点に基づくデザイン設計が重要と考えます。
オルトメディコでは、各分野の専門医や研究者に加え、統計学者と協議しながらの試験設計が可能です。これまでのヒト臨床試験の実績を生かし、貴社製品の安全性評価の取組をサポートさせていただきます。
- <参考資料>
-
- 1)Food and Agriculture Organization of the United Nations, World Health Organization. GENERAL PRINCIPLES OF FOOD HYGIENE CXC 1-1969[Internet].2022 [cited 2024 Jan 10]. Available from:https://www.fao.org/fao-who-codexalimentarius/sh-proxy/en/?lnk=1&url=https%253A%252F%252Fworkspace.fao.org%252Fsites%252Fcodex%252FStandards%252FCXC%2B1-1969%252FCXC_001e.pdf
- 2)厚生労働省. 致命的でない疾患に対し長期間の投与が想定される新医薬品の治験段階において安全性を評価するために必要な症例数と投与期間 (平成7年5月24日付審第592号厚生省薬務局審査課長通知)[Internet]. 1995 [cited 2024 Jan 4]. Available from: https://www.pmda.go.jp/files/000156199.pdf

ヒト臨床試験 (ヒト試験)
各種サポート業務等
各種お問い合わせは
お気軽にどうぞ
03-3812-0620 平日 | 9:00-17:00





