
様々な新着情報をお届けします
メルマガ
2025.04.09
SNSでもお役立ち情報を配信しています!いいね・フォローをお願いします。
1 はじめに
皆様、こんにちは。
私たちの【SPIRIT・CONSORT2024 特集】は楽しんでいただけているでしょうか?
↓前回の配信内容は、こちらよりご覧いただけます↓
今回も、Tunn Rらが公表した論文「Methods used to develop the SPIRIT 2024 and CONSORT 2024 Statements」について紹介させていただきます!
2 本日の内容
今回は、「アウトカム (項目6a)」に着目していきましょう。
アウトカムの修正案は以下の通りです。
| Item No | Checklist item |
| 6a 【従来】 |
Completely defined pre-specified primary and secondary outcome measures, including how and when they were assessed |
| 6a 【修正案】 |
Completely defined pre-specified primary and secondary outcome measures for both benefits and harms, including the specific measurement variable, analysis metric, method of aggregation, and time point for each outcome. Explanation of the clinical relevance of chosen efficacy and harm outcomes is strongly recommended |
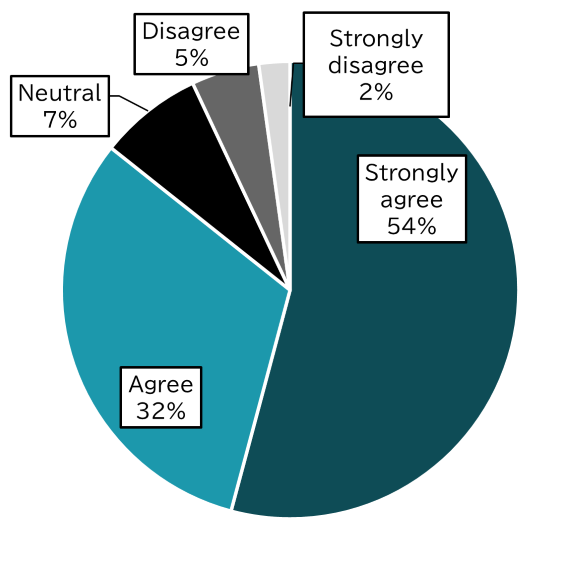
この項目はDelphi surveyのRound 1の時点で「Strongly agree」と「Agree」の合計が85.6%でした。
かなりの確率で、この項目も追加されるのではないでしょうか?
今回の変更は、SPIRITの項目12との文言と調和させるために修正されています。
従来までの文言は、アウトカムの定義や測定方法が不明確であったため、選択的報告バイアスが生じるリスクが指摘されていました。これらの問題に対処するため、アウトカムに関する詳細な情報の提供を求めるように修正が入ったのだと考えられます。
具体的な内容は・・・
主要アウトカムや副次的アウトカムが完全に定義されている必要があり、各アウトカムの具体的な測定変数、解析指標、集計方法、時点を明確にする必要があります。
機能性表示食品の臨床試験も少しずつ質があがっていますが、
いまだに主要アウトカムを「血圧」のように変数名を記載しただけの臨床試験がみられます。
正しい記載の仕方は、「CONSORT-Outcomes 2022」をチェックしましょう。
記載の仕方の1つを紹介します。
臨床試験の主な変数は、連続変数、2値変数、生存時間が主となることが多いですよね。
それらの例の一覧をまとめました。

No2の段階で記載をやめてしまっている研究が多いです。
しっかり最後まで、記載しましょう。
例を示すと、
主要な有効性評価項目は、オムロンの上腕式血圧計で測定された12週時点の収縮期血圧とし、ベースラインからの変化量の平均値を被験食品群とプラセボ群で比較することで評価した。なお、血圧測定は4週、8週、12週の来院時に実施した。
です。
具体的で分かりやすいと思いませんか?
複数測定していても12週目の測定が主要であることや、変化量を解析すること、平均値を比較することが伝わりますよね。
このような要領で書いてみてください☆
3 まとめ
今日は「アウトカム (項目6a)」を紹介しました。
アウトカムの詳細な報告により、
① 試験の透明性
② 再現性の確保
③ バイアスの低減
につながり、RCTの報告の質が高まりますね。
アウトカムの書き方は非常に重要です。
なぜなら、解析方法や集計方法にも直結するからです。
書き方に不安を覚えたらすぐにオルトメディコまでご連絡ください。
いつでも対応します。
4 参考文献
| ● | Tunn R, Boutron I, Chan AW, Collins GS, Hróbjartsson A, Moher D, Schulz KF, de Beyer JA, Hansen Nejstgaard C, Østengaard L, Hopewell S. Methods used to develop the SPIRIT 2024 and CONSORT 2024 Statements. J Clin Epidemiol. 2024; 169: 111309. (PMID: 38428538) |
| ● | Schulz KF, Altman DG, Moher D; CONSORT Group. CONSORT 2010 statement: updated guidelines for reporting parallel group randomised trials. BMJ. 2010; 340: c332. (PMID: 20332509) |
| ● | Chan AW, Tetzlaff JM, Altman DG, Laupacis A, Gøtzsche PC, Krleža-Jerić K, Hróbjartsson A, Mann H, Dickersin K, Berlin JA, Doré CJ, Parulekar WR, Summerskill WS, Groves T, Schulz KF, Sox HC, Rockhold FW, Rennie D, Moher D. SPIRIT 2013 statement: defining standard protocol items for clinical trials. Ann Intern Med. 2013; 158(3): 200-7. (PMID: 23295957) |
| ● | Chan AW, Tetzlaff JM, Gøtzsche PC, Altman DG, Mann H, Berlin JA, Dickersin K, Hróbjartsson A, Schulz KF, Parulekar WR, Krleza-Jeric K, Laupacis A, Moher D. SPIRIT 2013 explanation and elaboration: guidance for protocols of clinical trials. BMJ. 2013; 346: e7586. (PMID: 23303884) |
| ● | Butcher NJ, Monsour A, Mew EJ, Chan AW, Moher D, Mayo-Wilson E, Terwee CB, Chee-A-Tow A, Baba A, Gavin F, Grimshaw JM, Kelly LE, Saeed L, Thabane L, Askie L, Smith M, Farid-Kapadia M, Williamson PR, Szatmari P, Tugwell P, Golub RM, Monga S, Vohra S, Marlin S, Ungar WJ, Offringa M. Guidelines for Reporting Outcomes in Trial Reports: The CONSORT-Outcomes 2022 Extension. JAMA. 2022; 328 (22): 2252-2264. (PMID: 36511921) |
 |
 |
|
 |
 |
|
 |
 |
 |
 |
 |
 |
 |
 |

ヒト臨床試験 (ヒト試験)
各種サポート業務等
各種お問い合わせは
お気軽にどうぞ
03-3812-0620 平日 | 9:00-17:00